
血管内皮细胞不仅在机体组织的氧气和营养供给方面发挥着重要作用,还与血管内皮生长因子共同驱动了新血管的生成,在肿瘤等疾病的血管新生中发挥重要作用。抗肿瘤血管新生(anti-angiogenesis)治疗是以血管内皮细胞为靶点,通过抑制内皮细胞增殖和迁移、改变肿瘤生长微环境,从而抑制肿瘤生长过程中的血管新生,切断肿瘤的供养,最终达到遏制肿瘤生长和转移的目的。深入解析血管新生分子机制,探寻潜在关键治疗靶点对于肿瘤治疗至关重要。
肿瘤团队多年来研究证实G蛋白抑制性α亚单位1和3(Gαi1/3蛋白)是肿瘤进程中的关键靶点。在多个细胞和生长因子刺激下,Gαi1/3和受体酪氨酸激酶(RTKs)等受体结合介导下游信号转导(Protein & Cell 2022 [1], Oncogene 2018, 2021[2, 3],IJBS 2022[4],Theranostics 2018,2021a/b[5-7]等论文)。Science杂志的Senior Editor Dr. Brian Ray评述:“Gαi蛋白可能是抑制癌细胞的治疗靶点”。
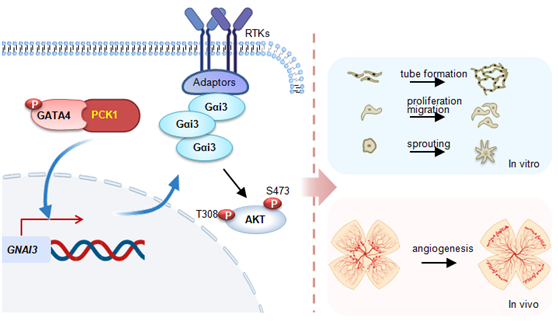
磷酸烯醇丙酮酸羧激酶1(PCK1)是催化糖异生关键限速酶。2021年肿瘤团队在Nature子期刊Cell Death & Disease杂志(IF:8.469)发表了“Identification of phosphoenolpyruvate carboxykinase 1 as a potential therapeutic target for pancreatic cancer(PCK1作为胰腺癌潜在治疗靶点的鉴定)”的研究论文[8],发现PCK1作为激酶在胰腺癌中高表达并发挥着重要的生物学作用,并且可能可以成为潜在的胰腺癌治疗靶点。2022年5月27日,肿瘤团队在Science Advances(Science 子刊,IF=14.143)发表了题为“The requirement of phosphoenolpyruvatecarboxykinase 1 for angiogenesis in vitro and in vivo”研究论文,该研究揭示了PCK1在促Gαi3表达及血管新生中的关键作用。

研究发现在体外培养的人脐静脉内皮细胞、人视网膜毛细血管内皮细胞和人脑微血管内皮细胞中,敲减及敲除PCK1抑制细胞成管、增殖、迁移、浸润及出芽;而过表达PCK1促体外血管新生作用。C57小鼠内皮细胞特异性敲减PCK1后显著抑制P1(出生后第一天)到P5小鼠视网膜血管发育;在成年小鼠中,PCK1敲减导致视网膜血管渗漏和无细胞毛细血管生长,同时降低视网膜神经节细胞的数量。
机制研究发现PCK1的促血管作用并不依赖于其促糖异生功能。PCK1与转录因子GATA4互作并促GATA4磷酸化;后者通过与Gαi3启动子结合,促Gαi3转录、表达及下游Akt的活化,最终导致血管新生。而敲减、敲除PCK1几乎阻断GATA4磷酸化,下调Gαi3表达及Akt的活化。总之,PCK1通过介导Gαi3表达及Akt活化促血管新生。PCK1是血管新生的新靶点。
原文链接:http://doi.org/10.1126/sciadv.abl9806
肿瘤团队陈敏斌教授和曹聪教授是该论文的共同通讯作者。
参考文献
1. Liu F, Chen G, Zhou L, Wang Y, Zhang Z, Qin X, Cao C. YME1L overexpression exerts pro-tumorigenic activity in glioma by promoting Gαi1 expression and Akt activation. Protein Cell. 2022.
2. Liu YY, Chen MB, Cheng L, Zhang ZQ, Yu ZQ, Jiang Q, Chen G, Cao C. microRNA-200a downregulation in human glioma leads to Galphai1 over-expression, Akt activation, and cell proliferation. Oncogene. 2018; 37: 2890-902.
3. Lv Y, Wang Y, Song Y, Wang SS, Cheng KW, Zhang ZQ, Yao J, Zhou LN, Ling ZY, Cao C. LncRNA PINK1-AS promotes G alpha i1-driven gastric cancer tumorigenesis by sponging microRNA-200a. Oncogene. 2021; 40: 3826-44.
4. Bian ZJ, Shan HJ, Zhu YR, Shi C, Chen MB, Huang YM, Wang XD, Zhou XZ, Cao C. Identification of Galphai3 as a promising target for osteosarcoma treatment. Int J Biol Sci. 2022; 18: 1508-20.
5. Wang Y, Liu YY, Chen MB, Cheng KW, Qi LN, Zhang ZQ, Peng Y, Li KR, Liu F, Chen G, Cao C. Neuronal-driven glioma growth requires Galphai1 and Galphai3. Theranostics. 2021; 11: 8535-49.
6. Bai JY, Li Y, Xue GH, Li KR, Zheng YF, Zhang ZQ, Jiang Q, Liu YY, Zhou XZ, Cao C. Requirement of Galphai1 and Galphai3 in interleukin-4-induced signaling, macrophage M2 polarization and allergic asthma response. Theranostics. 2021; 11: 4894-909.
7. Sun J, Huang W, Yang SF, Zhang XP, Yu Q, Zhang ZQ, Yao J, Li KR, Jiang Q, Cao C. Galphai1 and Galphai3mediate VEGF-induced VEGFR2 endocytosis, signaling and angiogenesis. Theranostics. 2018; 8: 4695-709.
8. Zhu XR, Peng SQ, Wang L, Chen XY, Feng CX, Liu YY, Chen MB. Identification of phosphoenolpyruvate carboxykinase 1 as a potential therapeutic target for pancreatic cancer. Cell Death Dis. 2021; 12: 918.
服务热线: 0512-57559009
母婴热线: 0512-57026117
东部新院区:昆山市前进东路566号

关注微信公众号
Copyright © 2013 昆山市第一人民医院 版权所有 未经许可不得转载 苏ICP备14019617号